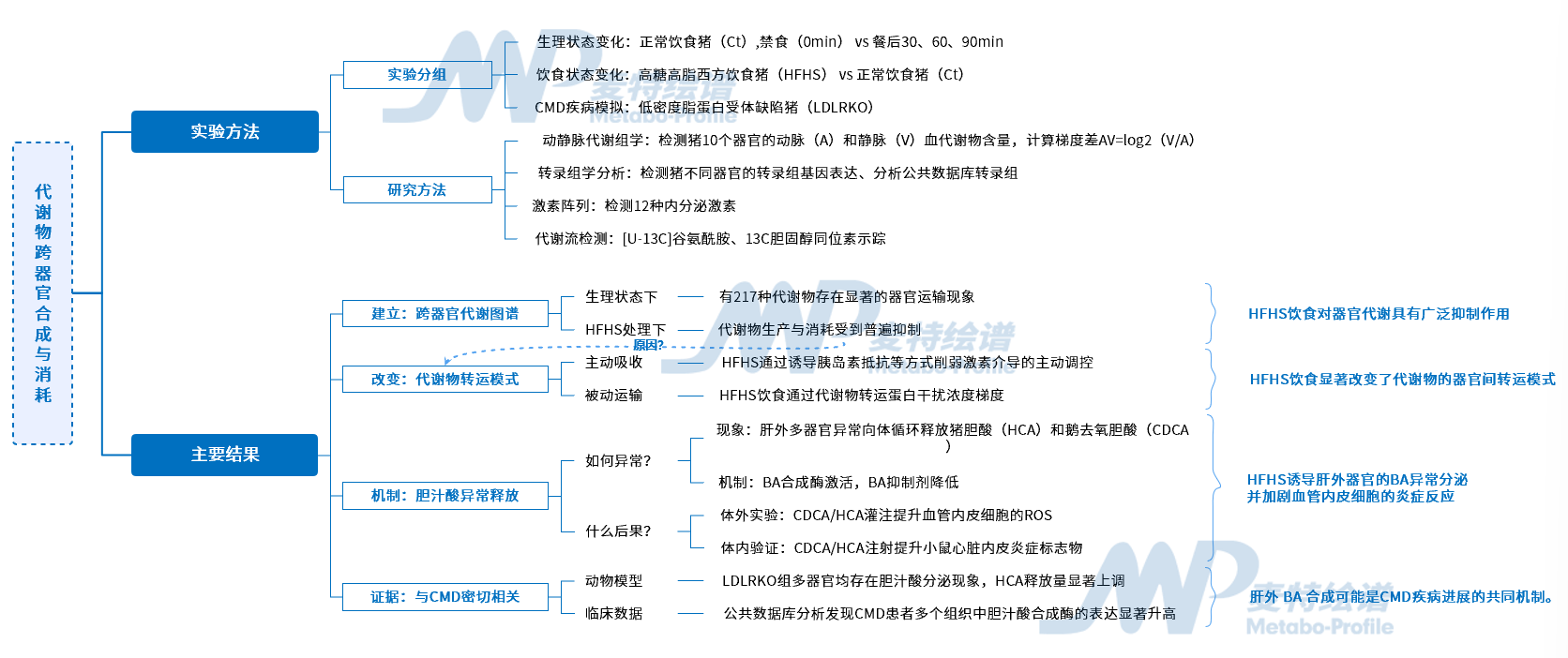
哺乳动物机体是一个精密运转的网络,各器官协同调节循环代谢物的生成与消耗,共同维系生命稳态。器官间通过代谢物进行动态对话,当葡萄糖、胆固醇等关键代谢物的平衡被打破,便有可能引发心脏代谢疾病(CMD),累及多个器官的功能。然而如致病因素(如西方饮食或慢性高胆固醇血症)如何干扰这一复杂的代谢网络并最终促进CMD,仍是亟待破解的谜题。
在CMD的研究过程中,传统组学技术虽提供了宝贵的静态分子图谱,却难以捕捉器官代谢活动的动态过程。随着质谱技术的重大突破,动静脉(AV)代谢梯度(代谢组学)分析有望突破此局限,该方法通过计算动静脉浓度差可直接量化器官的代谢物净产出(Δ>0)或消耗(Δ<0),有望成为解析器官代谢活动的关键利器。
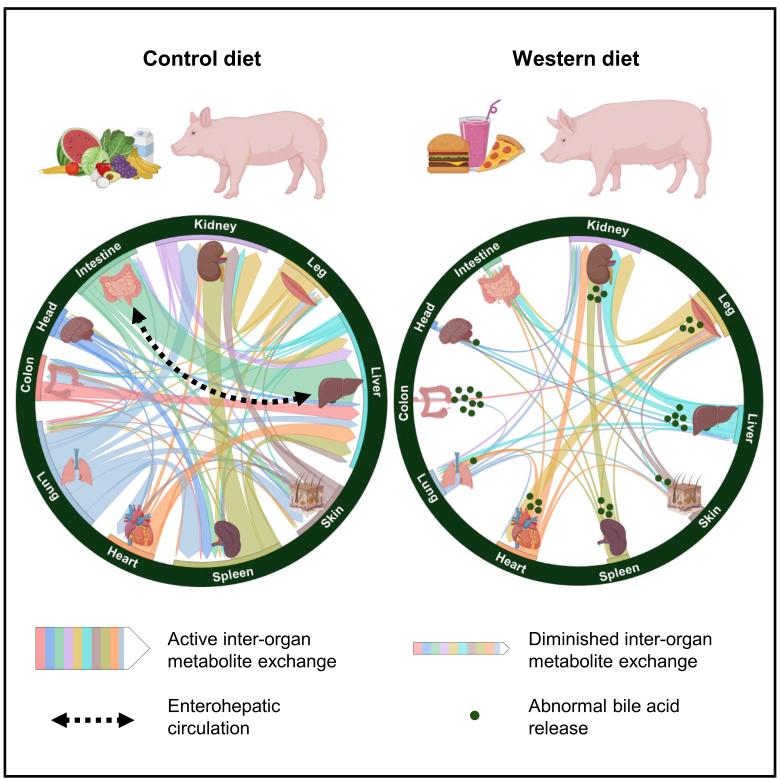
基于此,2025年5月,加州大学Cholsoon Jang研究团队在Cell上发表了题为“Cross-organ metabolite production and consumption in healthy and atherogenic conditions”的研究论文,通过对LDLR(低密度脂蛋白受体)缺陷猪模型进行多器官AV代谢组学分析,系统解析了不同饮食和病理条件下的全局代谢物产生与消耗图谱。此外,该研究首次揭示出西方饮食会诱导肝外器官异常释放胆汁酸,且这一现象在LDLR缺陷猪中显著加剧,为深入理解CMD的病理机制提供了新的关键线索。
技术路线图
研究结果
1. 禁食/喂养对器官代谢的基础影响
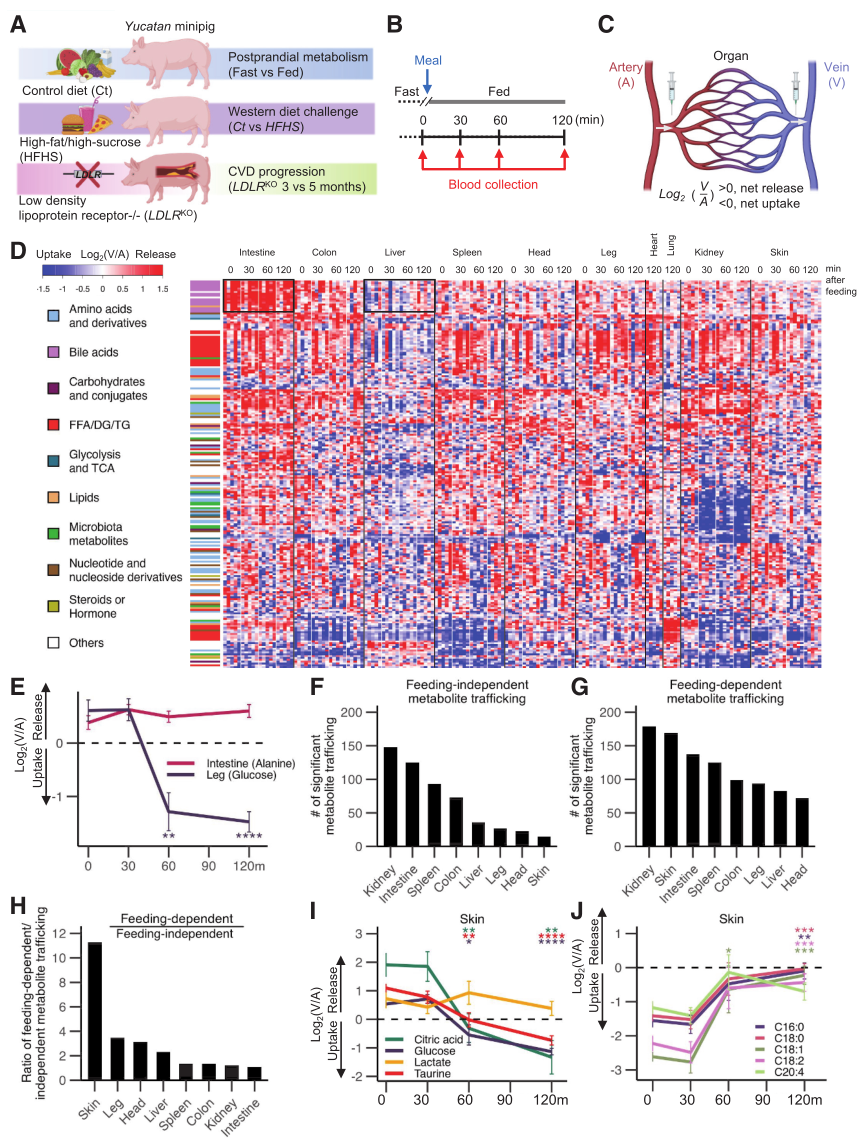
首先通过动静脉(AV)代谢组学分析,研究者在10个器官的4个时间点(禁食及喂养后 30、60、120分钟)跟踪了1305种循环代谢物,其中217种在特定器官或时间点存在显著转运差异。进一步分析显示,540例代谢事件不依赖食物摄入,如肠道持续释放丙氨酸、肾脏摄取氨基酸,主要富集于腹腔内脏器官;958例事件依赖喂养,如腿部肌肉餐后葡萄糖摄取,以肾脏和皮肤最为敏感,这些提示了餐后组织重塑的代谢需求。
图1. 禁食和进食对器官特异性代谢物运输的影响
2. 西方饮食(HFHS)对代谢网络的系统性抑制
鉴于西方饮食与心脏代谢疾病的明确因果关联,研究者进一步探究了高脂/高蔗糖(HFHS)饮食对器官代谢物生成与消耗的影响。结果表明,2周HFHS饮食诱导下,猪的体重、胰岛素水平及HOMA-IR显著升高,动脉血脂质、核苷酸和胆汁酸水平异常,但空腹血糖、呼吸频率等无明显变化。AV梯度测量显示,相比于正常饮食的对照组(Ct),HFHS组中1368种代谢物的器官生产与消耗普遍减弱,喂养依赖性事件数量减少。以葡萄糖为例,Ct组腿部肌肉餐后|Δlog₂V/A|为1.9~2.1,而HFHS组仅0.1~0.2,反映胰岛素抵抗导致的葡萄糖摄取障碍。类似缺陷也存在于皮肤、脑等器官,同时肝脏糖异生抑制能力受损。整体而言,HFHS组78%的代谢物|Δlog₂V/A|<1.0,远高于Ct组的29%,证实其缺陷对器官代谢的广泛抑制。
图2. 西方饮食喂养对器官特异性代谢物运输的影响
3. 代谢物生产位点的重分配与调控机制
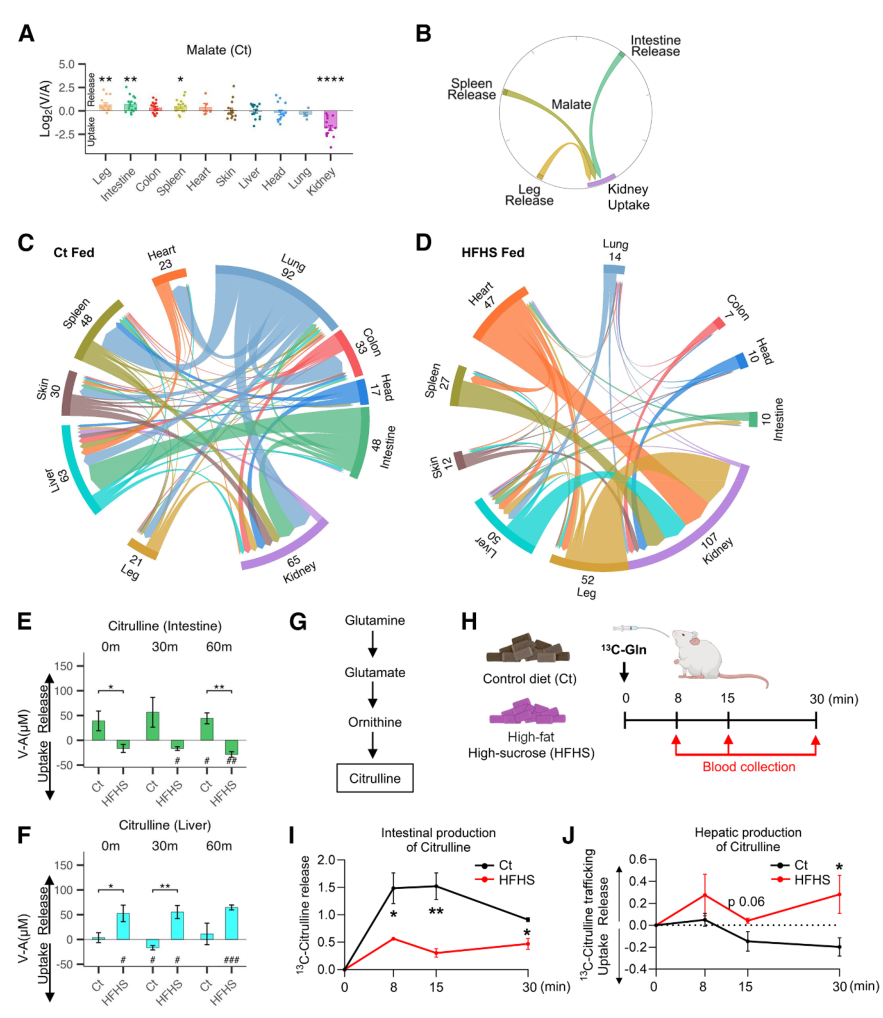
接下来对每种代谢物进行统计分析,确定其显著释放或吸收的器官,绘制循环代谢物的主要来源与目标的器官图谱。AV数据显示,HFHS饮食显著改变了代谢物的器官间转运模式,以瓜氨酸为例,Ct组中该物质主要由肠道生产,而HFHS组则转向肝脏,小鼠的[U-13C]谷氨酰胺代谢流结果验证了这一切换,伴随体重增加和胰岛素抵抗等表型的改变。
图3. 西方饮食对器官之间代谢物运转的影响
在机制方面,研究者揭示了HFHS饮食通过双重机制破坏器官代谢调控:
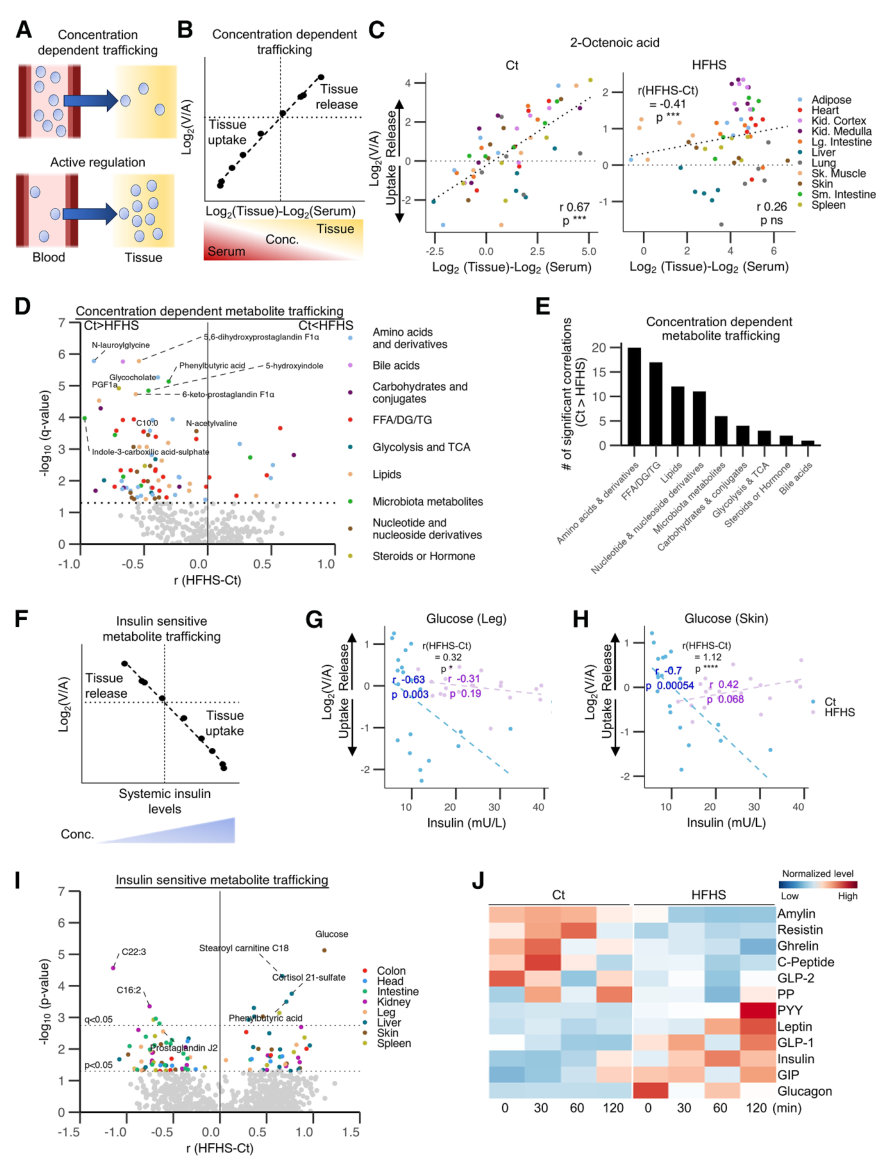
被动运输:这种物质运输由浓度梯度介导,即物质会从高浓度区域流向低浓度区域。因此首先通过相关性分析,筛选出229种代谢物在Ct组的转运与组织-血液的浓度梯度显著正相关,即它们的转运由浓度梯度驱动,其中包含以2-辛烯酸为代表的多种有机酸;而在HFHS组中,该相关性普遍减弱,转录组分析显示对应的代谢物转运蛋白表达异常。
主动运输:这是一种逆浓度梯度的物质运输方式,往往受到激素的调节。以机体血糖调节为例,细胞在胰岛素的诱导下主动摄取葡萄糖,从而降低血糖浓度。在Ct组中,胰岛素水平与腿部和皮肤的葡萄糖摄取强相关,而在HFHS组中由于胰岛素抵抗,这种相关性消失。
图4. 通过浓度梯度或激素调节进行代谢物运输
总之,HFHS饮食一方面干扰浓度梯度驱动的被动运输,另一方面通过诱导胰岛素抵抗等方式削弱激素介导的主动调控,最终导致器官代谢物生成与消耗的整体紊乱。
4. 肝外器官胆汁酸的异常释放及病理作用
尽管HFHS饮食普遍抑制器官的代谢物生成与消耗,但研究者也发现酰基肉碱和胆汁酸等胆固醇衍生物的生成显著增强。在Ct组中,胆汁酸的释放与摄取符合经典的肝肠循环模式,而在HFHS组中,心、肺等多器官异常向体循环释放猪胆酸(HCA)和鹅去氧胆酸(CDCA),致系统血中BA 水平升高。机制方式,首先通过全器官转录组测序发现,相较于Ct组,HFHS组的BA合成酶(CYP7A1、CYP27A1 等)表达上调,而BA抑制剂(FGF19)的水平降低3倍,说明胆固醇向胆汁酸的转化增强,或为HFHS下机体为缓解循环胆固醇升高的代偿机制。
在代谢紊乱和心血管疾病患者中,循环胆汁酸水平长期呈现异常升高状态,且血液胆汁酸浓度与脂肪性肝炎及冠状动脉狭窄的严重程度呈正相关,基于此,研究者推测具有细胞毒性的胆汁酸可能对血管内皮细胞(ECs)产生损害,体外实验中,CDCA/HCA的微流控灌注可显著提升ECs的ROS生成和单核细胞粘附;体内实验中,CDCA/HCA的1:1输注使小鼠心脏中的内皮炎症标志物Vcam-1和Icam-1的表达显著增加,其作用程度与阳性对照脂多糖(LPS)相当。以上结果证实BA可触发血管炎症。
图5. HFHS饮食导致多个器官异常胆汁酸释放
5. LDLR缺陷猪与人类CMD患者的肝外BA合成证据
在当前的诊疗实践与临床研究中,CMD患者循环胆汁酸水平升高通常被归因于肝脏来源,而其他器官的潜在贡献尚未得到充分考量。因此,研究者利用LDLR缺陷(LDLRKO)猪模型,结合3-5个月的致动脉粥样硬化饮食干预(高脂高糖+1%胆固醇),成功模拟了人类代谢性心肌病(CMD)的核心病理特征,包括高胆固醇血症、冠状动脉粥样硬化等。与HFHS组相似,LDLRKO组的AV检测结果显示多器官均存在胆汁酸分泌现象,且HCA的释放量显著高于HFHS组。此外,LDLRKO组的FGF19水平较HFHS组更低,提示FGF19水平下降可能是驱动血液胆汁酸升高的关键机制。最后通过分析人类转录组数据集,发现在CMD患者多个组织中胆汁酸合成酶的表达显著升高,提示肝外BA合成可能是CMD疾病进展的共同机制。
图6. LDLRKO模型猪CMD患者肝外器官BA合成的研究
全文总结
本研究采用动静脉代谢组学、组织转录组学及多激素检测平台,系统解析了猪在禁食/进食状态、西式饮食诱导(HFHS)及低密度脂蛋白受体缺陷(LDLRKO)相关心血管疾病进展过程中的跨器官代谢动态。通过整合关键代谢物在10种主要代谢器官的摄取/释放通量数据,构建了进食依赖性与非依赖性代谢物交换的时空图谱。研究揭示:
(1)多器官存在进食状态特异性代谢物交换模式
(2)西式饮食通过重塑代谢物浓度梯度及干扰FGF19/FGF21-FXR信号轴,破坏器官间代谢协同
(3)LDLR缺陷与西式饮食协同诱导肝外器官(如心脏、骨骼肌)胆汁酸(BA)异常分泌,并通过激活血管内皮炎症通路加剧动脉粥样硬化
本研究首次阐明了病理状态下器官间代谢干扰的层级网络,为饮食-遗传交互作用驱动心脏代谢疾病的机制研究提供了系统性资源。
参考文献
Bae H, Jung S, Le J, et al . Cross-organ metabolite production and consumption in healthy and atherogenic conditions. Cell. 2025
请扫描二维码阅读原文
绘谱帮你测
麦特绘谱公司的经典胆汁酸产品已协助数千家合作单位开展肝病、肠病、心血管疾病、糖尿病、肥胖、衰老、肿瘤/癌症、畜牧动物、中药等领域功能研究,已发表项目文章100+篇,其中大于10分的50+篇,涵盖Cell Metabolism, Nature Metabolism, Nature Communications, Nature Aging, Advanced Science, Microbiome, Science Advances等期刊。近期公司的原研新品【胆汁酸全新修饰谱】检测项目重磅发布,有望助力临床医生和科研人员深入挖掘新型修饰胆汁酸的巨大临床功能价值,助您的成果更上一层楼,圆梦顶刊!