巨噬细胞作为先天免疫系统的核心组成部分,能够动态呈现多种功能状态。例如,在感知到脂多糖(LBS)和干扰素-γ(IFNγ)等与感染相关的经典激活信号后,巨噬细胞首先启动促炎功能以清除病原体;随后这些反应逐渐减弱,并转变为促进组织修复与炎症消退的表型。这一功能转换常伴随代谢的动态重编程,后者在巨噬细胞的免疫应答中起关键作用。
近十年来,越来越多研究致力于识别不同功能状态下的巨噬细胞代谢特征,并解析关键代谢变化如何调控其免疫功能。理解免疫应答中代谢重编程的机制与意义具有广泛重要性,然而,除中心碳代谢和脂代谢途径以外,巨噬细胞在更广泛代谢网络中的特性仍待深入探索。
2025年8月,美国威斯康星州莫格里奇研究所的Jing Fan教授团队在Nature Metabolism上发表了题为“Classically activated macrophages undergo functionally significant nucleotide metabolism remodelling driven by nitric oxide”的研究结果,揭示了巨噬细胞在经典激活过程中核苷酸代谢的全面重编程,发现一氧化氮(NO)是这一过程的关键调控因子,并阐明了这种代谢重编程的功能意义。

一. 技术路线图

二. 研究结果
1.刺激后,巨噬细胞的核苷酸代谢发生重编程
首先,通过对巨噬细胞M1极化过程的代谢组学分析,研究者发现LPS+IFNγ刺激24小时后,核苷酸代谢(包括嘌呤、嘧啶及磷酸戊糖途径)与精氨酸代谢、TCA循环等共同发生显著重编程。持续或急性刺激均引发核苷酸代谢明显改变,表现为IMP积累和dTTP耗竭,且持续刺激效应更强,而急性刺激下的变化在72-96小时可逆,提示该过程具有动态适应性。
转录组分析进一步支持上述发现:基因表达呈时间依赖性变化,并在96小时恢复近基线状态。核苷酸降解相关基因(如Pnp1、Pnp2、Upp1)早期显著上调,而合成基因(如Rrm1、Rrm2)则下调。GO分析中“核苷碱基化合物代谢过程调控”条目显著富集,从转录层面确认了核苷酸代谢在M1激活中的关键重编程作用。
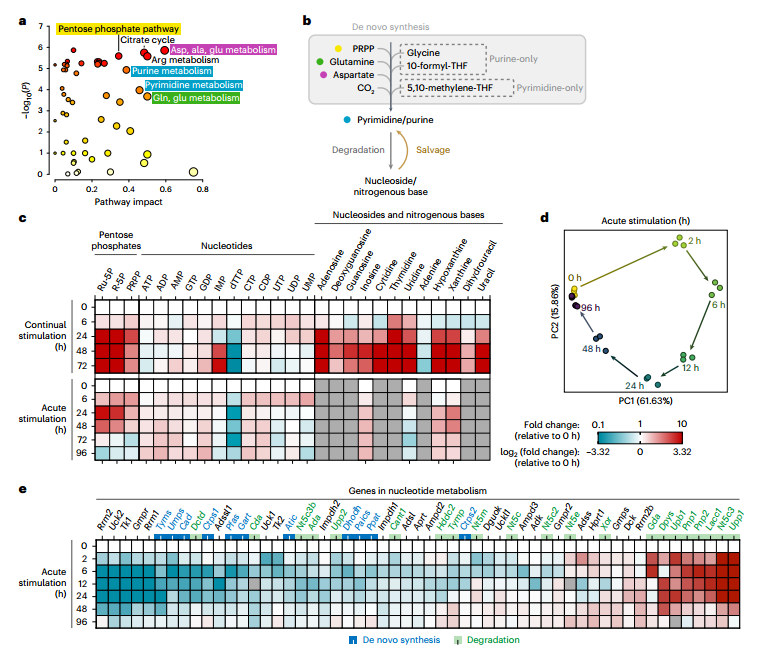
图1. 多组学分析发现核苷酸代谢重编程
2.核苷酸由从头合成转向补救合成
为解析巨噬细胞经典激活中核苷酸代谢通量的变化,研究者采用稳定同位素示踪技术进行了多维度分析。γ-¹⁵N-谷氨酰胺标记实验显示,尽管刺激后UMP的标记比例上升,但其下游产物dTMP、CTP和dCTP的标记完全消失,提示由三磷酸胞苷合成酶(CTPS)和胸苷酸合成酶(TYMS)催化的嘧啶核苷酸合成途径被显著阻断。同样的,在嘌呤合成通路中,关键中间体AICAR仍可被标记,但其下游产物IMP的标记比例大幅下降,表明AICAR向IMP的转化过程受阻。
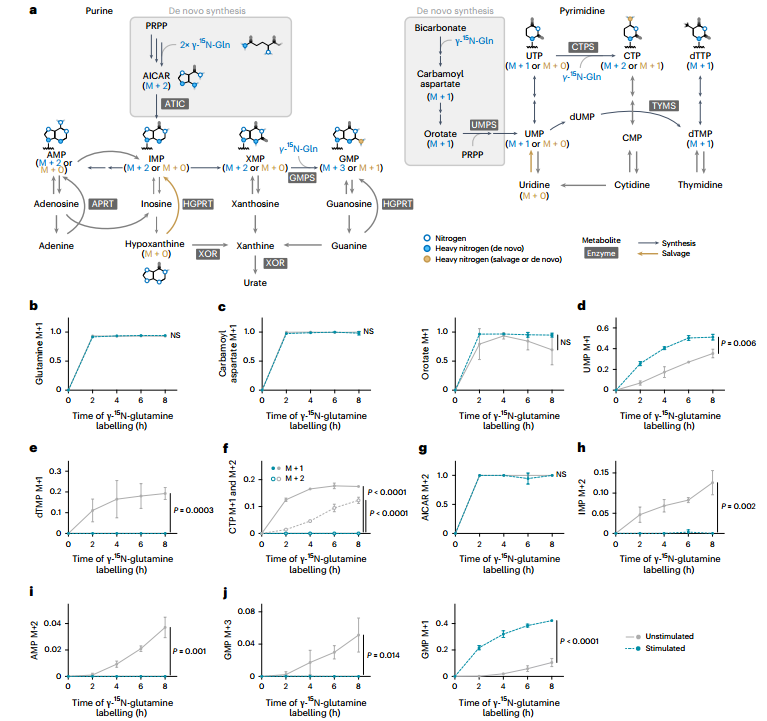
图2. 谷氨酰胺代谢流显示核苷酸从头合成阻滞
值得注意的是,尽管从头合成被抑制,胞内多数嘌呤核苷酸水平仍维持稳定,暗示存在替代途径进行补给。进一步通过¹⁵N标记模式区分合成途径发现:刺激后,含3个标记氮(M+3)的GMP(从头合成来源)几乎消失,而含1个标记氮(M+1)的GMP(补救合成来源)显著增加,证实细胞转向依赖补救合成以维持嘌呤核苷酸稳态。U-¹³C-葡萄糖标记实验也支持补救途径的通量增强。
为直接验证外源嘌呤的利用能力,研究者使用U-¹⁵N-肌苷进行示踪,发现刺激后细胞对肌苷的摄取和转化为IMP的效率显著提高。此外,在Hprt1(次黄嘌呤-鸟嘌呤磷酸核糖转移酶,参与嘌呤补救合成)敲除细胞中,刺激导致的IMP积累现象几乎完全消失,证明HGPRT介导的碱基补救途径是维持IMP水平的关键机制。
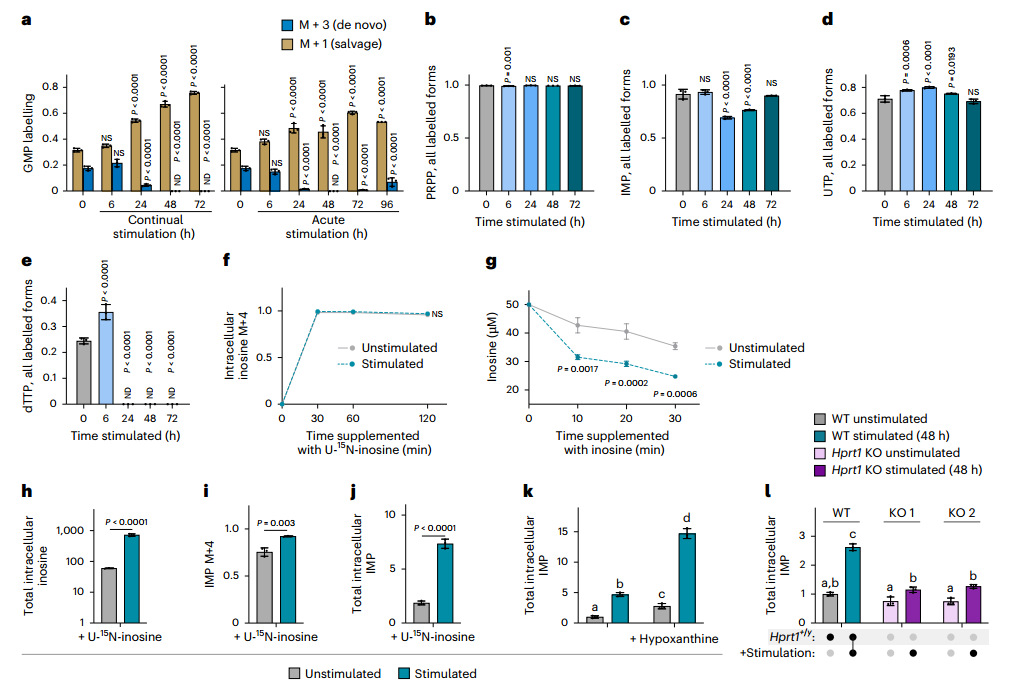
图3. 巨噬细胞转为嘌呤补救合成
3.核苷酸降解增强,但嘌呤碱基的完全氧化被阻断
先前的代谢组学显示,刺激后最显著变化之一是核苷和含氮碱基积累,这些核苷酸降解产物可作为补救合成底物。RNA-seq进一步证实,关键核苷酸降解酶(如PNP1、PNP2、UPP1、LACC1)表达显著上调,提示核苷酸降解发生重编程。为验证这点,研究者通过U-¹³C-葡萄糖的代谢流检测发现,刺激后BMDMs中IMP降解为肌苷的速率显著加快,与肌苷积累现象一致。此外,刺激不仅增加胞内核苷/碱基水平,还促进其向培养基释放,表明核苷降解为碱基的过程也得到增强。
随后,U-¹⁵N-肌苷代谢流直接检测了核苷酸的降解能力,结果显示刺激后巨噬细胞将肌苷转化为次黄嘌呤的速率提升,而其经黄嘌呤氧化还原酶(XOR)向黄嘌呤和尿酸的转化却受到显著抑制。这种代谢流转向使次黄嘌呤得以通过HGPRT补救为IMP。
为进一步验证PNP在次黄嘌呤积累和为补救合成提供底物中的作用,研究者用PNP抑制剂福达拉滨处理巨噬细胞。如预期所示,PNP抑制剂福达拉滨处理完全阻断刺激诱导的次黄嘌呤和IMP积累,并降低补救合成来源的GMP比例。这与Hprt1敲除结果共同证实:刺激通过增强PNP活性促进次黄嘌呤生成,同时抑制XOR介导的完全降解,使代谢流转向HGPRT依赖的补救合成,最终驱动IMP积累。
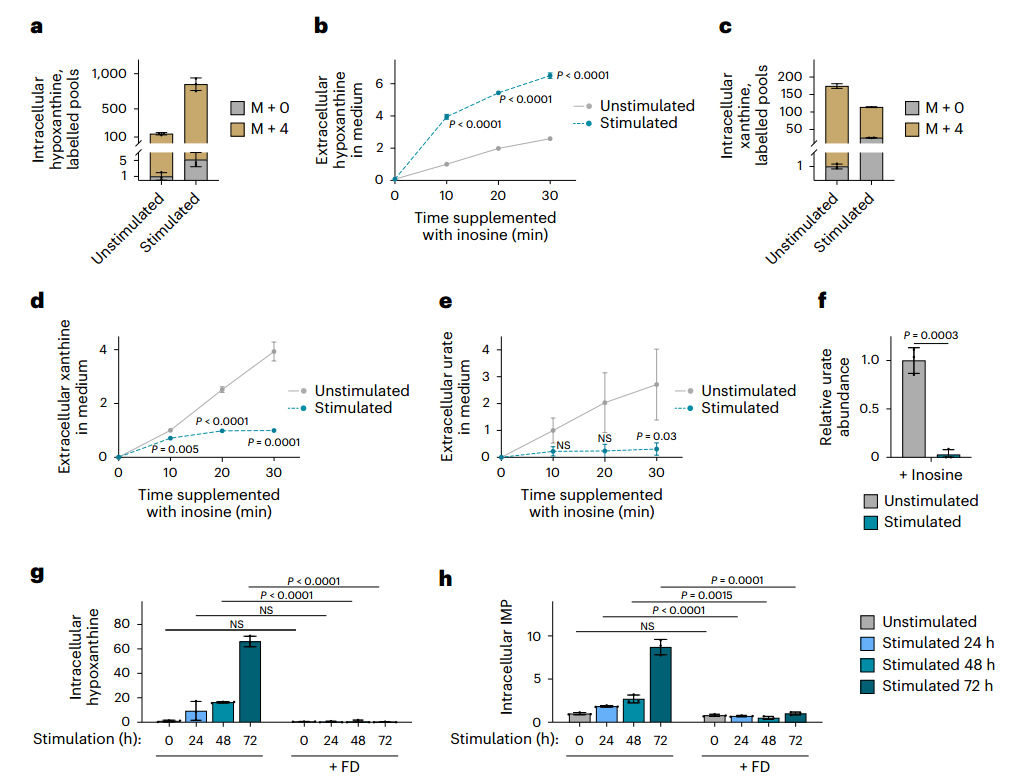
图4. 受刺激后,巨噬细胞的核苷酸降解发生变化
4.NO是核苷酸代谢重编程的关键驱动因子
关于核苷酸代谢重编程的分子机制,研究者首先提出了两种主流假设并逐一进行验证。第一种假设认为,核苷酸从头合成抑制可能源于一碳单位供应不足。然而,外源性补充一碳供体(如甲酸)及四氢叶酸辅因子(亚叶酸)均未能恢复核苷酸的合成,表明一碳代谢缺陷并非主要原因。第二种假说则聚焦于能量还原应激或前体物质匮乏,即NAD⁺/NADH比率失衡或天冬氨酸短缺。研究者在补充丙酮酸后,虽成功逆转了NAD⁺/NADH的下降并恢复了天冬氨酸水平,但核苷酸的从头合成仍处于抑制状态,从而排除了这一可能性。
在否定上述常见机制后,研究者转而从时序关联中寻找线索。通过动态监测发现,核苷酸合成抑制的发生时间与诱导型一氧化氮合酶(iNOS,由Nos2编码)的激活及一氧化氮(NO)大量产生高度同步。Western Blot及代谢组学数据证实,iNOS蛋白上调及其催化产物瓜氨酸的积累早于IMP和dTTP合成的受阻。转录组分析进一步显示,在Nos2诱导之后,胸苷酸合成酶(TYMS)编码基因Tyms等核苷酸合成关键基因的表达显著下调,提示NO可能调控这些基因的转录,进而关闭合成通路。
为确立NO的因果地位,研究者进行了功能增益与损失实验:在Nos2敲除(Nos2⁻/⁻)的巨噬细胞中,炎症刺激引发的核苷酸合成抑制被显著挽救;而在未刺激细胞中外源添加NO供体,则足以模拟出与炎症刺激类似的核苷酸抑制表型。综上所述,研究者通过严谨的排他性验证和时序‒功能分析,确立了NO是巨噬细胞在炎症应激下核苷酸代谢重编程的关键驱动因子。
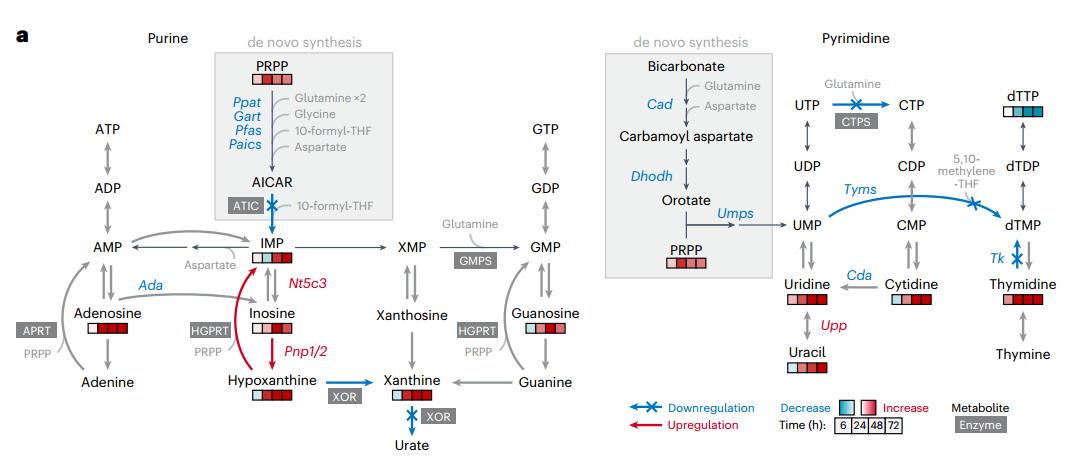
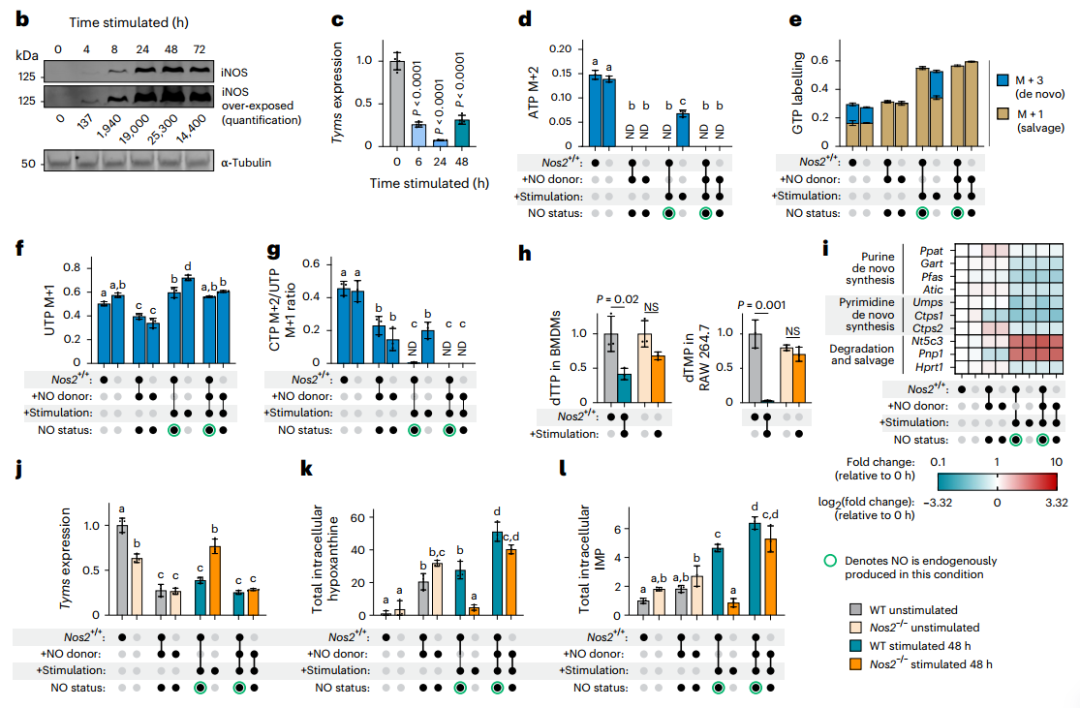
图5. NO在核苷酸代谢重编程中起关键作用
5.巨噬细胞通过核苷酸代谢重编程增强免疫防御
最后,研究者探讨了这种代谢重编程的功能意义。结果表明,由HGPRT介导的嘌呤补救合成对巨噬细胞的免疫功能具有关键作用。通过基因敲除(Hprt1 KO)或药物抑制(6-MP)阻断该途径后,巨噬细胞多项免疫功能受损:包括免疫应答基因(如 Ptgs2、Mmp14)表达下降、IL-10等细胞因子分泌减少、迁移能力减弱,以及对细菌颗粒的吞噬效率显著降低。更重要的是,在弓形虫感染模型中,研究发现宿主细胞的嘌呤补救合成能力直接限制病原体的复制。在Hprt1 KO的巨噬细胞中,由于无法有效竞争嘌呤底物,弓形虫增殖速度显著加快。
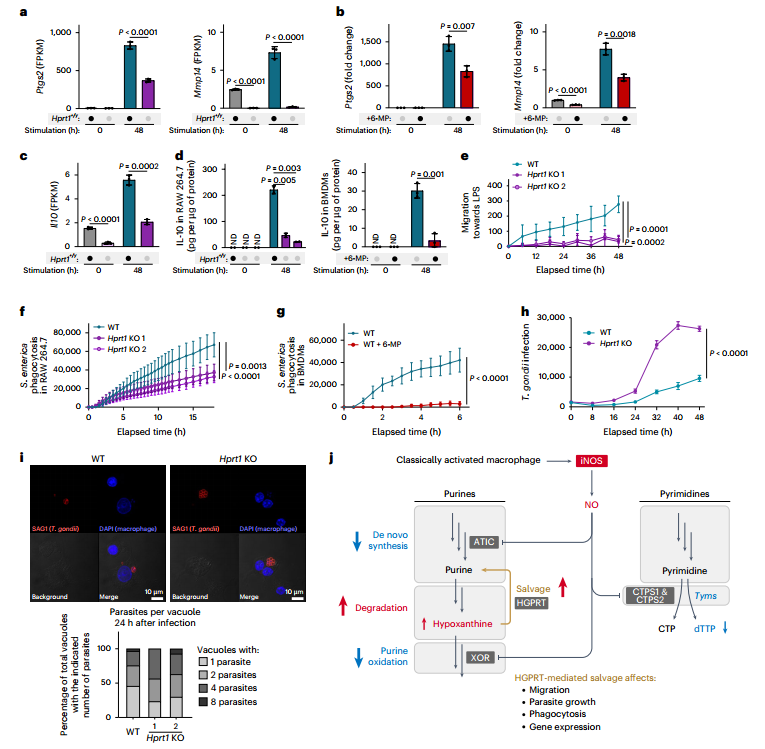
图6. 核苷酸代谢的改变影响巨噬细胞功能,抑制病原体增殖
综上所述,巨噬细胞在激活后转向补救合成不仅是一种维持自身核苷酸水平的代谢适应,更是一种主动的免疫策略:一方面支撑其迁移、吞噬和细胞因子产生等效应功能;另一方面通过在代谢层面竞争嘌呤资源,直接抑制细胞内病原体的增殖。
三、全文总结
本研究通过代谢组和代谢流检测发现,核苷酸代谢是巨噬细胞经典激活过程中变化最为显著的代谢通路之一。具体而言,嘌呤和嘧啶的从头合成被抑制,核苷酸降解为含氮碱基的过程被上调,但嘌呤碱基的完全氧化受到抑制,从而使代谢转向补救合成。从机制上,一氧化氮被确定为核苷酸代谢的关键调控因子,它同时驱动多个关键变化;干扰嘌呤补救合成后,可改变许多刺激应答相关基因的表达、抑制巨噬细胞的迁移与吞噬功能,并促进胞内寄生虫的增殖。
总之,本研究系统揭示了巨噬细胞经典激活过程中核苷酸代谢的动态重编程,并阐明了其调控机制与功能意义。
参考文献
John SV, Seim GL, Erazo-Flores BJ, et al. Classically activated macrophages undergo functionally significant nucleotide metabolism remodelling driven by nitric oxide. Nat Metab. 2025.
绘谱帮你测
本文利用代谢组学和多层级代谢流分析逐层阐释一氧化氮为核苷酸代谢的关键调控因子。麦特绘谱提供全面的靶向、非靶向代谢组学和代谢流检测服务,可追踪含13C和15N等被标记物100+种,全面覆盖糖酵解和TCA循环通路、磷酸戊糖途径、 氨基酸代谢、脂肪酸代谢、 一碳代谢、 核苷酸代谢通路等。丰富的个性化标记定制经验--[U-13C6]-Fructose,[U-13C16]-Palmitate, [U-13C3]-Serine,[U-13C2]-Glycine, [U-13C3]-Alanine, [U-13C3]-Pyruvate, [U-13C4]Malic Acid, [U-13C18]-Oleic Acid, 13CO2, 15N-NH4CL, [1, 2-13C2]-Glucose, [2,3,3-D3]-Serine, [2,3-13C2]Alanine, [1,2,3-13C3]-Choline等。历经数年项目积累,检测各类贴壁细胞、悬浮细胞、菌体、培养液、线粒体、组织、粪便等样本类型,涵盖多发性骨髓瘤、肝癌、线粒体遗传代谢病、免疫细胞活性与疾病、心血管疾病等多个研究方向,合作项目成果突出,文章平均IF>10+。
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱已为数百家三甲医院、科研院所和企业提供多组学一站式整体解决方案,协助客户与合作伙伴发表SCI文章600+篇,累计影响因子6000+,平均IF>10,涵盖Cell, Science, Nature, Cancer Cell, Signal Trans-duction and Targeted Therapy, Nature Biotechnology, Cell Metabolism等权威期刊。
